Les CaPI ou Carcinomes de Primitif Inconnu sont des cancers dont on ne peut déterminer l’origine malgré un bilan diagnostique et clinique standard. En résumé, aucun élément aidant habituellement au diagnostic d’un cancer ne permet de définir le point de départ de ces cancers. Les CaPI sont des cancers rares et représentent environ 1 à 3% des cas de cancers en France. Aujourd’hui, de nouveaux espoirs naissent grâce à la médecine génomique.
Carcinome de Primitif Inconnu : une entité à part entière
L’emplacement où le cancer naît est appelé « siège primitif » ou tumeur initiale. Lors de l’évolution d’un cancer, les cellules cancéreuses se propagent du siège primitif vers d’autres parties du corps. Cette propagation porte le nom de métastase. Les CaPI sont des cancers diagnostiqués à partir des sites métastatiques sans que l’on puisse identifier le siège primitif, son point de départ.
Dans certains diagnostics de cancer, les médecins ne parviennent donc jamais à détecter le siège primitif et le cancer est classé en CaPI.
Plusieurs hypothèses sont avancées à ce sujet :
- Le cancer développé par le patient est tellement agressif ou invasif (qui se propage dans l’organisme) qu’il n’est pas visible à l’examen radiologique.
- Lors du bilan diagnostique, seules les métastases sont visibles car le système immunitaire du patient a fait disparaître la tumeur initiale.
Le traitement standard des CaPI est actuellement une chimiothérapie comportant deux produits (Platine et Gemcitabine).
Dans le cas d’un CaPI confirmé, les médecins vont pouvoir avoir recours à une analyse génomique après avoir discuté du dossier lors d’une réunion de concertation nationale. Cette analyse permettra d’établir une « carte d’identité génétique » de la tumeur qui pourra aider les médecins à classer la tumeur et à proposer un traitement encore plus adapté au patient.
La médecine génomique : un outil précieux
Il n’existe pas un cancer par organe mais une multitude de sous-types de cancers caractérisés chacun par des marqueurs cellulaires spécifiques dont les anomalies génétiques. Une meilleure connaissance de ces anomalies, en particulier au niveau de l’ADN des cellules tumorales (les gènes de la tumeur), et de leurs conséquences sur les mécanismes de développement des cancers, a permis de mettre en place de nouveaux traitements qui conduisent à la destruction spécifique des cellules tumorales.
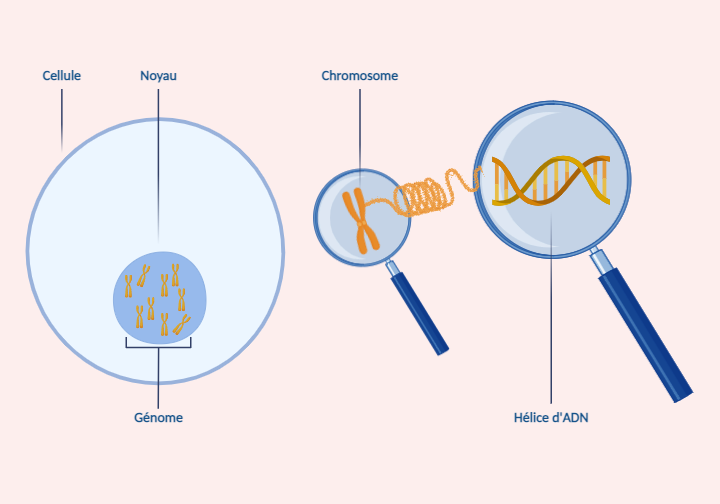
Schéma du génome
La médecine de précision est fondée sur l’analyse génomique. Le génome comprend l’ensemble de notre matériel génétique. Il est situé dans le noyau de toutes les cellules de notre organisme et il est constitué d’ADN. L’analyse génomique a pour objectif d’être en mesure de proposer au patient un traitement adapté aux caractéristiques génétiques de sa tumeur (une thérapie ciblée ou un traitement adapté), s’il existe.
Génétique vs Génomique, quelle est la différence ?
La génétique : étudie l’hérédité, soit la transmission d’un caractère (ou d’une maladie) d’une génération à une autre. Elle se focalise essentiellement sur l’étude des gènes, en particulier sur leur association à des maladies et à leur traitement.
La génomique : est une science beaucoup plus récente. Le génome contient l’ensemble des gènes d’un organisme contenu dans chacune de ses cellules sous la forme de chromosomes.
Une plateforme nationale appuie la médecine génomique
Pour aider les médecins dans le diagnostic et le traitement des différents types de cancers agressifs ou rares (dont les CaPI), il existe une plateforme nationale nommée « Plan France Médecine Génomique ». Le Plan France Médecine Génomique 2025 (PFMG2025) vise à faire évoluer à l’horizon de 2025 la façon de diagnostiquer, prévenir, et soigner les patients.
Le but de ce plan est d’intégrer le Séquençage génomique Très Haut Débit (STHD) au parcours de soin du patient afin d’améliorer :
- La prise en charge des patients
- Les connaissances actuelles concernant certaines pathologies
Dans le cadre du PFMG, deux laboratoires de séquençage à très haut débit (STHD) couvrant l’ensemble du territoire français sont actuellement opérationnels :
L’interprétation des analyses et du séquençage se fait par différents biologistes en France, dont les biologistes du service du Dr Dominique VAUR, chef de service du Laboratoire de Biologie et de Génétique du Cancer du Centre Baclesse.
En ce qui concerne les CaPI, le dispositif a deux objectifs :
- Le premier, à visée diagnostique : l’analyse permet de reclasser environ 2/3 des cas étudiés, c’est à dire d’identifier le siège primitif à partir d’une bibliothèque de données de cancer (un peu comme le système des empreintes génétiques). Il peut s’agir de cancers du rein, du poumon, du pancréas mais les CaPI peuvent également prendre naissance dans d’autres organes.
- Le second, à visée théranostique (contraction de thérapie et diagnostic) : ce sont des analyses des caractéristiques génétiques dont le résultat va influencer le traitement.
Au Centre Baclesse, un peu plus de 30 cas sont pris en charge chaque année (34 cas en 2023) et plus de la moitié des dossiers sont analysés par la plateforme SeqOIA.
Les différentes anomalies génétiques
Les analyses génomiques peuvent permettre de mettre en évidence différents types d’anomalies génétiques :
- Des anomalies propres à la tumeur.
- Des anomalies du patrimoine génétique du patient, ces anomalies peuvent être héréditaires.
En fonction des anomalies moléculaires identifiées, le médecin peut prescrire un médicament (ou thérapie) ciblé et/ou proposer au patient de participer à un essai clinique évaluant un nouveau médicament.
Si des variations génétiques héréditaires ont été identifiées, et si le patient a donné son accord pour connaitre les résultats, le médecin peut orienter le patient vers le service d’oncogénétique du Centre Baclesse pour une consultation. Un suivi personnalisé pour le patient et les membres de sa famille sera proposé.
L’expertise de Baclesse dans les carcinomes de site primitif inconnu

Le Centre Baclesse dispose d’une Unité CaPI, dédiée à la prise en charge de ce type de cancers. Des réunions hebdomadaires sont organisées pour discuter des dossiers des patients concernés par cette pathologie. Les dossiers discutés sont adressés par des médecins oncologues travaillant au Centre Baclesse ou dans des hôpitaux extérieurs. Ce sont des patients qui sont souvent en errance diagnostique du fait des difficultés à établir le diagnostic.
L’accès au plan France Médecine Génomique est proposé aux patients du Centre Baclesse depuis 2022. Au Centre Baclesse, le Dr Zoé NEVIERE et Dr Djelila ALLOUACHE prennent en charge plus de 30 cas par an. Un réseau d’expertise nationale se dessine afin de permettre une prise en charge plus rapide et un meilleur maillage territorial. Des essais thérapeutiques sont également en cours de développement notamment grâce à des organoïdes et pourrait permettre une médecine très personnalisée pour ces patients.




